
Classe 3 ème
Chapitre4. Réaction de l'acide chlorhydrique avec les métaux.
Exercices
Exercice1 : Une solution acide a un pH=2.3. On verse cette solution dans 100 mL d'eau distillée.
• Comment évolue le pH de cette nouvelle solution ?
• Pourquoi a-t-on choisi de verser l'acide dans l'eau et non l'inverse ?
Exercice 2 : On a écrit trois équations -bilans traduisant l'action de l'acide chlorhydrique sur le zinc :
Zn 2+ + H 2 ? Zn + 2H + (1)
Zn + 2H + ? Zn 2+ + H 2 (2)
2 Zn + H + ? Zn 2+ + H 2 (3)
Exercice 3 : Deux bouteilles contenant, l'une une solution d'acide chlorhydrique, et l'autre une solution de soude ont perdu leurs étiquettes.
Quelles techniques, étudiées dans les chapitres précédents, pourriez-vous utiliser pour les reconnaître ?
Exercice 4 : a) Décrire le test du dihydrogène.
b) Ce test est une combustion.
Ecrire l'équation -bilan, sachant qu'il ne se forme que de l'eau.
Exercice 5 : Une solution de sulfate de cuivre a été versée sur du fer en poudre.

• Que devient le fer qui disparaît?
• D'où provient le cuivre qui se forme?
• Quelle équation –bilan correspond à la réaction illustrée par le schéma?
Fe 2+ + Cu ? Fe + Cu 2+ (1)
Fe 2+ + Cu ? Fe + Cu (2)
Fe + Cu 2+ ? Fe 2+ +Cu (3)
Fe 2+ + Cu 2+ ? Fe + Cu (4)
Exercice 6 : Au journal télévisé, il a été dit que : « les ions aluminium dans l'eau pourraient être à l'origine de certaines affections touchant en particulier les personnes âgées ».
Afin de comprendre pourquoi des ions aluminium peuvent être présents dans l'eau, on a réalisé l'expérience suivante.
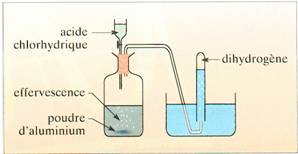
1) Le liquide restant dans le flacon est filtré. Pourquoi ?
• On récupère le filtrat et on en fait deux parts :
_ dans une part, on verse de la soude,
_ dans l'autre part, on verse une solution de nitrate d'argent.
Dans les deux cas on obtient un précipité blanc. Quels ions sont présents
dans le filtrat : écrivez leurs formules.
3) Ecrivez l'équation -bilan de la réaction de l'aluminium avec l'acide
chlorhydrique.
4) Formulez une hypothèse expliquant la présence des ions aluminium dans
l'eau.
Exercice 7 : Ecrire l'équation -bilan simplifiée de la réaction de l'acide chlorhydrique sur l'aluminium.
Le vinaigre, constitué essentiellement d'acide acétique (C 2 H 4 O 2 ), réagit avec l'aluminium. Pourquoi ne doit-on pas faire une vinaigrette dans un récipient en aluminium ?